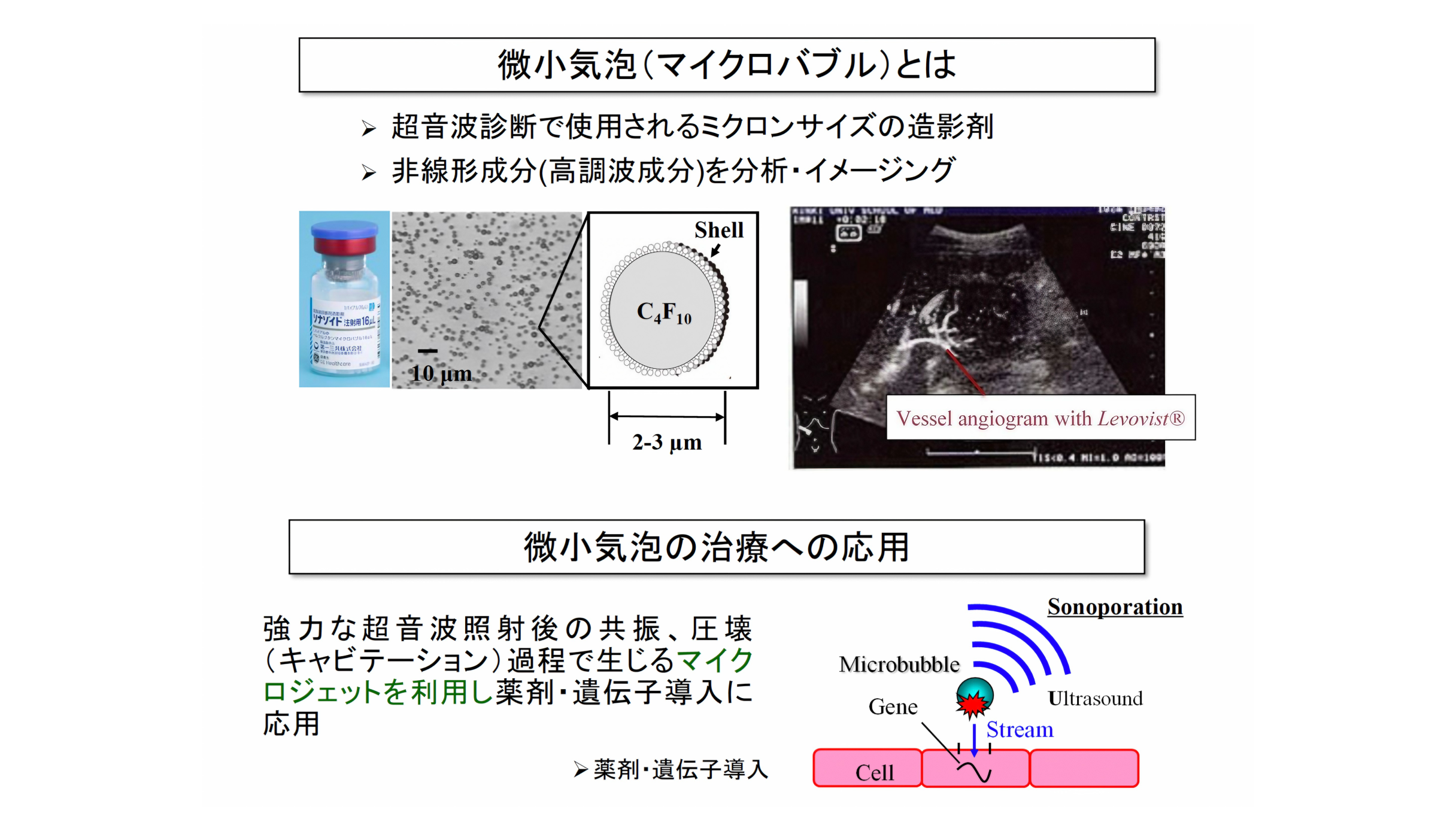
微小気泡とは
微小気泡は従来、超音波診断において造影剤として使用されてきました。気泡の非線形成分、高調波成分を分析・イメージングすることで、血管のみがハイコントラストで造影できます。近年では、気泡を圧壊させる過程で生じるマイクロジェットを利用した薬剤・遺伝子導入への応用が行われています。
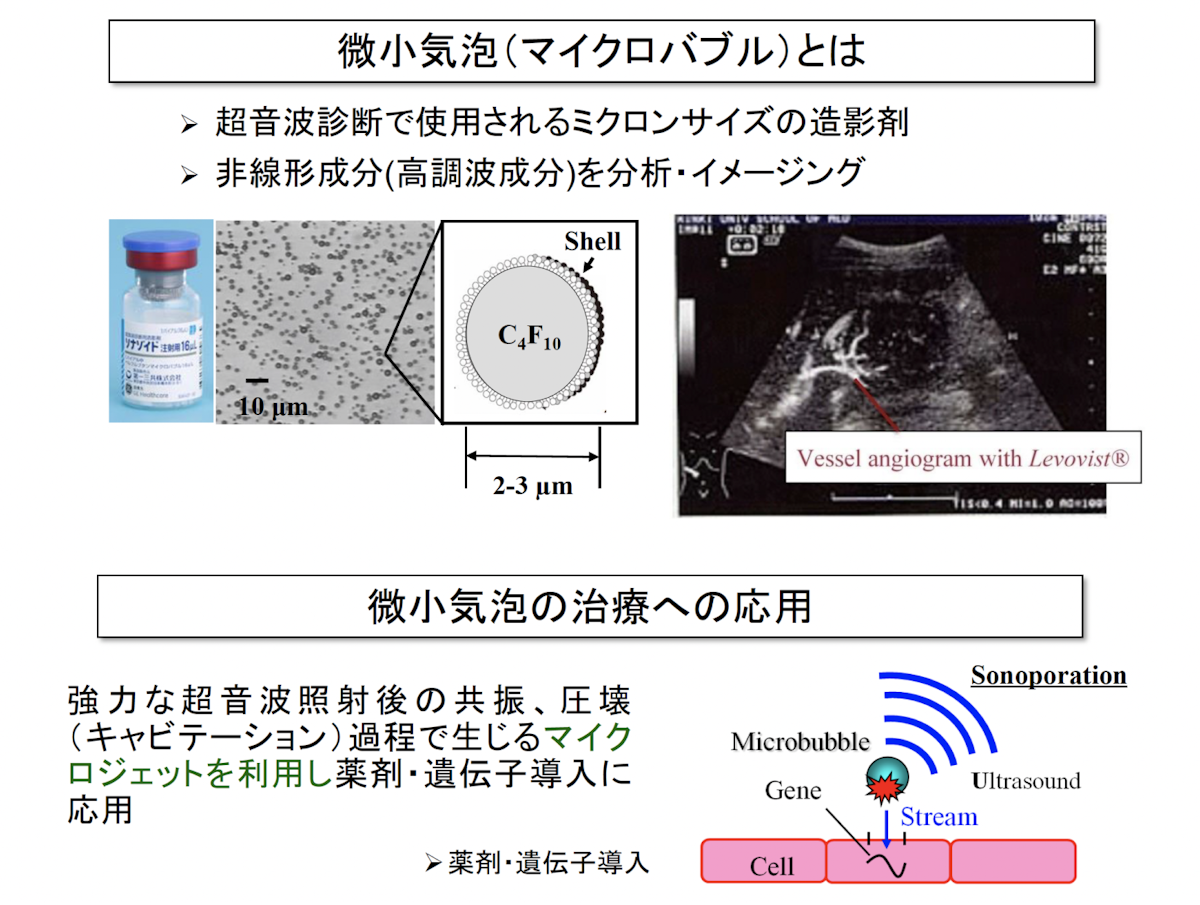
微小気泡は幾つかの世代に分けられ、現在は第三世代と呼ばれるシェル付きの血中安定性に優れた微小気泡が登場しています。既に日本で造影用途としての許可が降りているため、私たちの研究でもこの第三世代の微小気泡を使用しています。
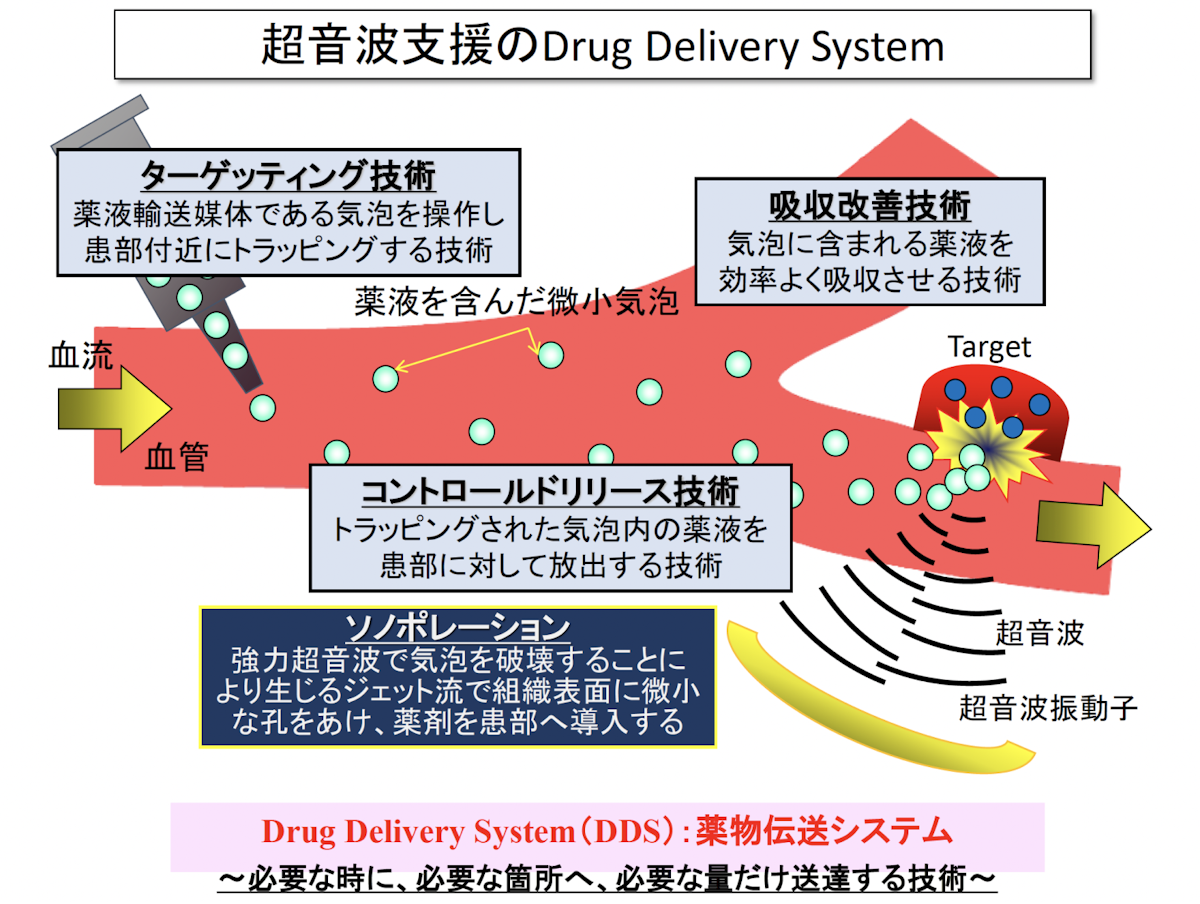
高圧な超音波下で発生する微小気泡の現象
微小気泡に超音波を照射すると、気泡振動の振動振幅が大きくなり気泡が破壊され、破壊の際に周囲にマイクロジェットを発生したり、周囲媒体に大きな機械的作用や化学的作用を及ぼします。これを「キャビテーション」といいます。また、キャビテーションにより生じるマイクロジェットにより細胞壁に可逆的な小さな穴を開け、これにより細胞内に薬剤などの成分を取り込ませることを「ソノポレーション」といいます。
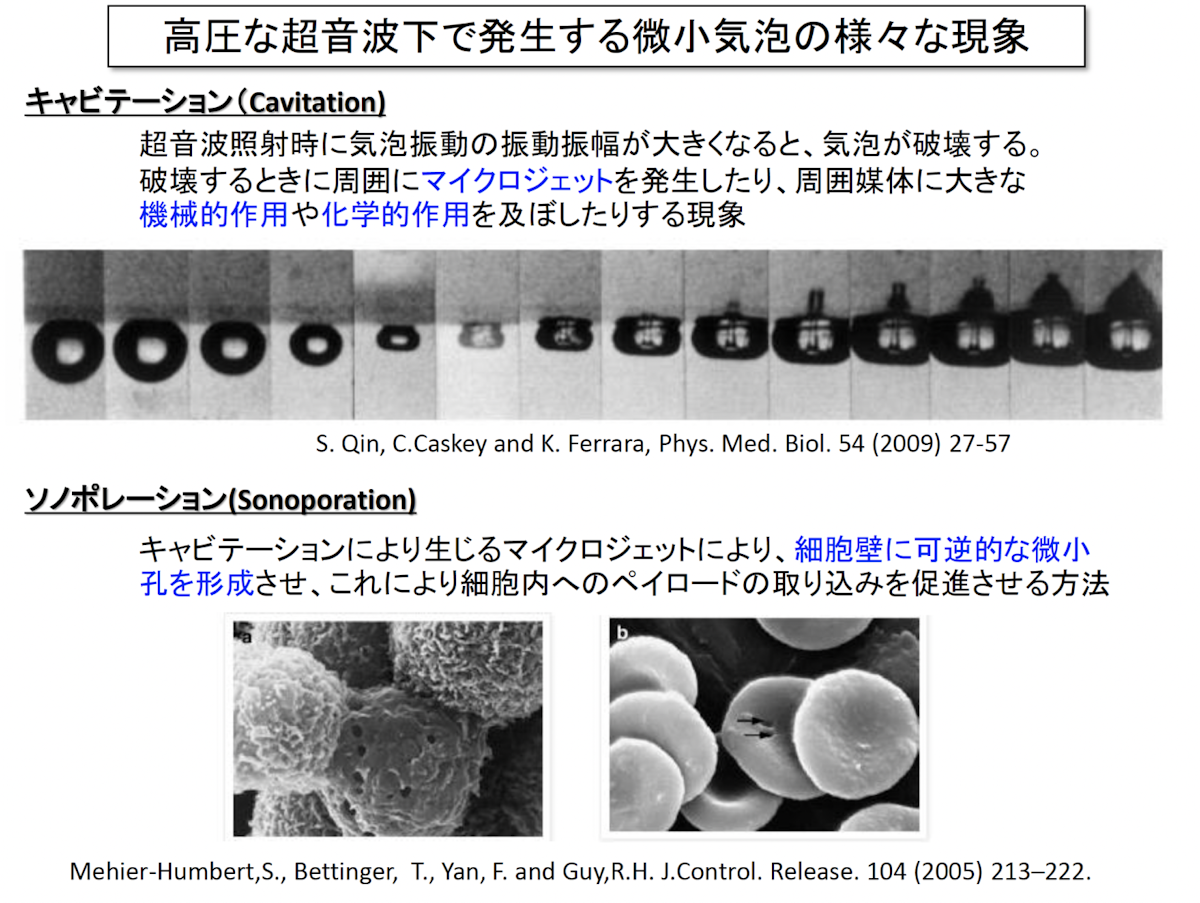
Drug Delivery System(DDS)の仕組みと課題
こちらが超音波を用いたDrug Delivery System(DDS)の全体図です。
薬剤を含んだ微小気泡を血管内に流し、超音波の力で疾患部付近にバブルを集積させ、ここに強力な超音波を照射することで、気泡破壊を起こします。これにより、必要な時に、必要な箇所へ、必要な量だけを送達する効率的な薬物伝送システムの実現が可能となります。
ただし、DDSには課題もあります。効果を確認するためには、実験の標本となる動物の準備・解剖が必要となり、また実験後の効果の確認も容易ではありません。また、動物を使った実験は効率が低く、気泡の投与量に対し有効に働いているのは数%程度であると考えられます。
群馬大学のマイクロバブル/ナノバブル観測技術
DDSの課題に対する解決策として、私たちは超音波の照射を観測しフィードバックする技術を研究しています。
血管内を流れる気泡に超音波が照射されると、気泡はクラウド化を伴って複雑な挙動を示して、キャビテーションに至ります。このときに生じる信号を別の超音波プローブで受信し、これをその場で超音波の照射システムへフィードバックすることで、効率を向上させるということを目的にしています。
観測技術は、市販の超音波装置を用いた2つの方法と、研究開発用の超音波装置を用いた2つの方法に分けられます。市販装置を用いる方法ではリアルタイムでのフィードバックが可能になり、研究開発装置を用いた方法ではより詳細な観測が可能となります。
市販装置を用いた観測
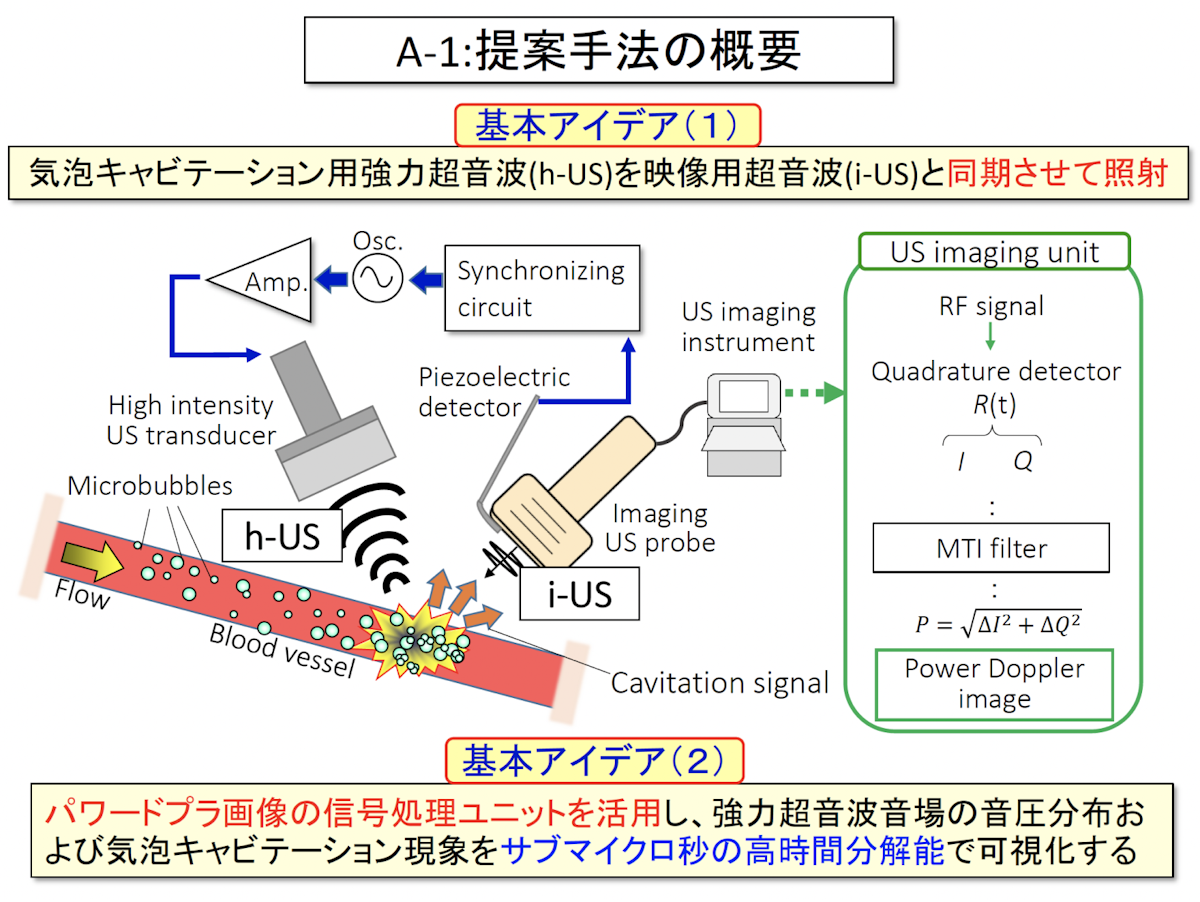
パワードプラ画像を利用したその場観測法
市販の超音波装置を用いた観測の一つ目は、パワードップラーと呼ばれる画像を利用してキャビテーション信号をその場で観測する方法です。
この方法では2つの超音波装置を使用します。強力な超音波をこの映像用超音波と同期させて照射することよって、市販装置のパワードプラ画像の信号処理ユニットになんら改造を加えることなく、キャビテーションの観測が可能になります。
装置構成としては、観測用の市販の超音波装置のプローブ前面にピエゾのセンサーを取り付け、これによって観測用超音波の送信タイミングを検知します。これに同期をかけて強力超音波を照射すると、強力超音波の照射により発生したキャビテーションによる信号を観測用プローブが受信することができます。実験では、寒天ブロックの中に直径2ミリの穴を開けてここにマイクロバブルを注入しています。そのマイクロバブルに対して、観測プローブと垂直の方向から強力超音波を照射しました。
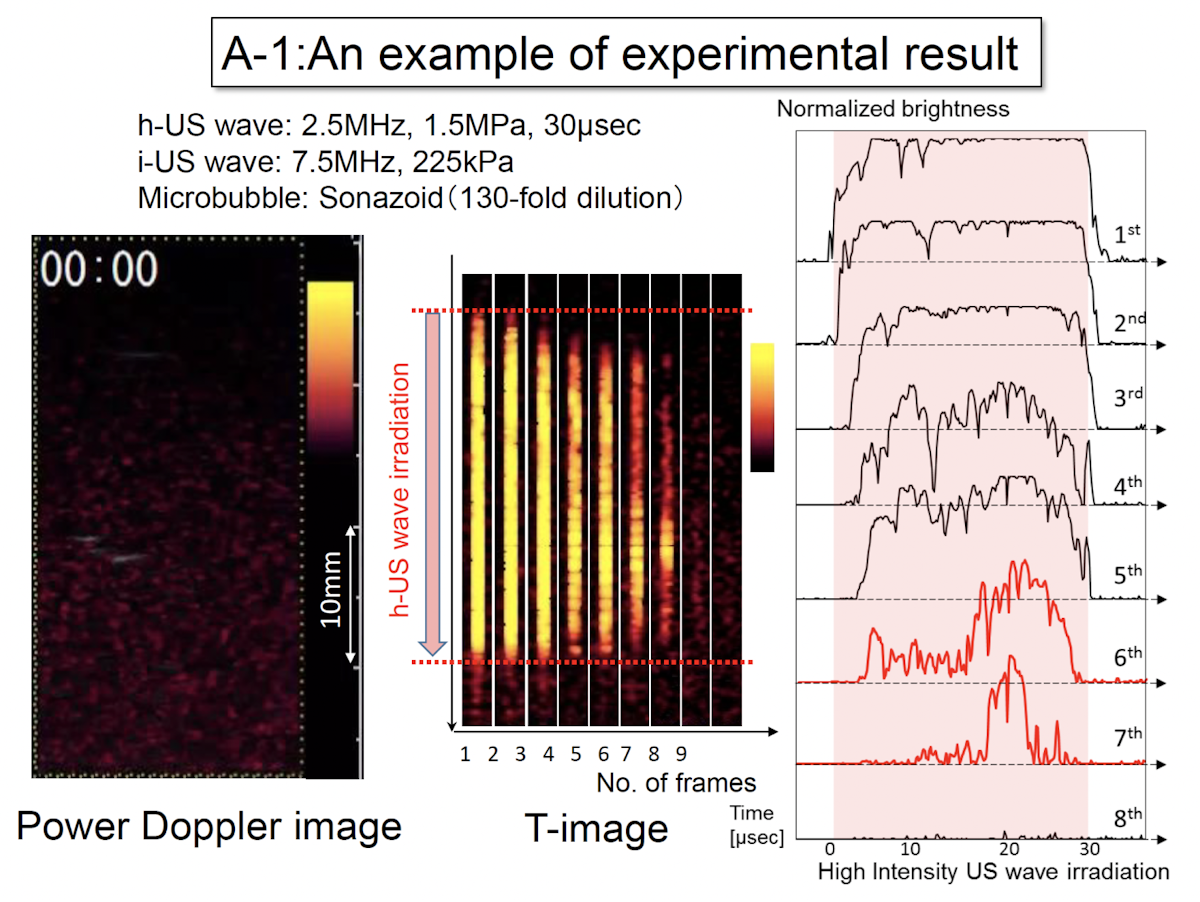
パワードプラ画像により、強力な超音波が照射されキャビテーション信号が発生しているということがリアルタイムで可視化されます。
実験では複数回にわたって超音波の照射を行いますが、各照射の画像を切り出して並べたものがT画像です(下図真ん中)。これは縦方向が時間になっており、明るくなっている部分がキャビテーション信号を受信していることを示しています。強力超音波の1照射目2照射目は照射時間の全般にわたって信号が生じていますが、照射の回数が進むごとに、信号がだんだん弱くなっているのがわかります。また、1回の照射において、前半よりも後半の方がまだ信号が強くなっています。このように時間方向に見たときに、従来は知られていなかった信号挙動がわかりました。
こちらの方法は、従来のドップラーを用いない観測方法よりも高感度にキャビテーション信号を検出することができるため、気泡特性の違いも観測することができます。
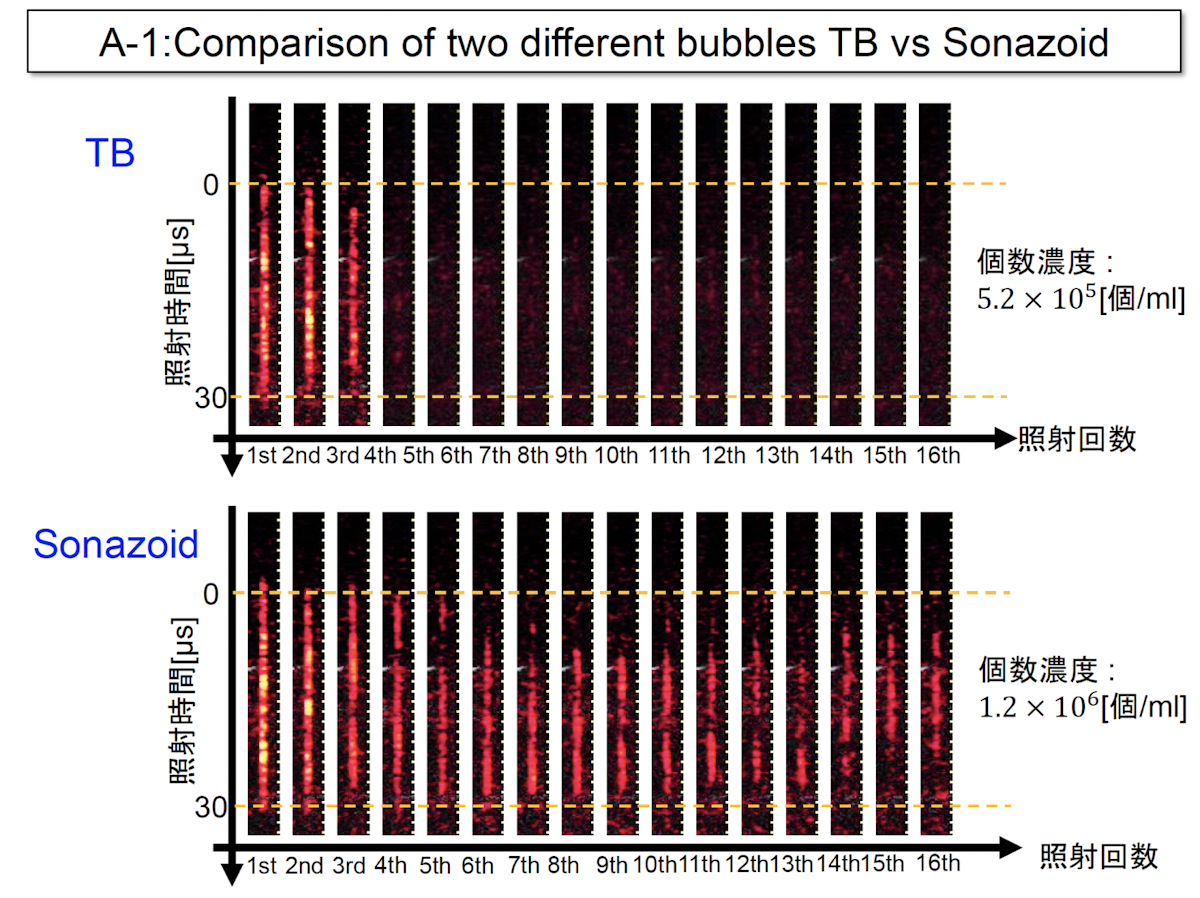
例えば、セラノステックスバブルという治療用の気泡と従来の気泡を比較すると、治療用の気泡の方が、照射が2照射目で信号が現れなくなるということがわかりました(下図のTB)。一方、従来の気泡であるマイクロバブルは、長い間信号が続いています(下図Sonazoid)。
この原因を探るため高速度カメラにより気泡を観測すると、強力な超音波照射が進むと、マイクロバブルは気泡同士が結合してクラウド化し、それにより割れ残ってしまうことがわかりました。一方、治療用の気泡は、そういったクラウド化が見られないため、1回の照射でほとんど割れるものと思われます。
カラードプラ画像を利用したその場観測法
二つ目は、先ほどのパワードプラという振幅を見るモードではなく、カラードプラという周波数を見るモードで観測を行う方法です。
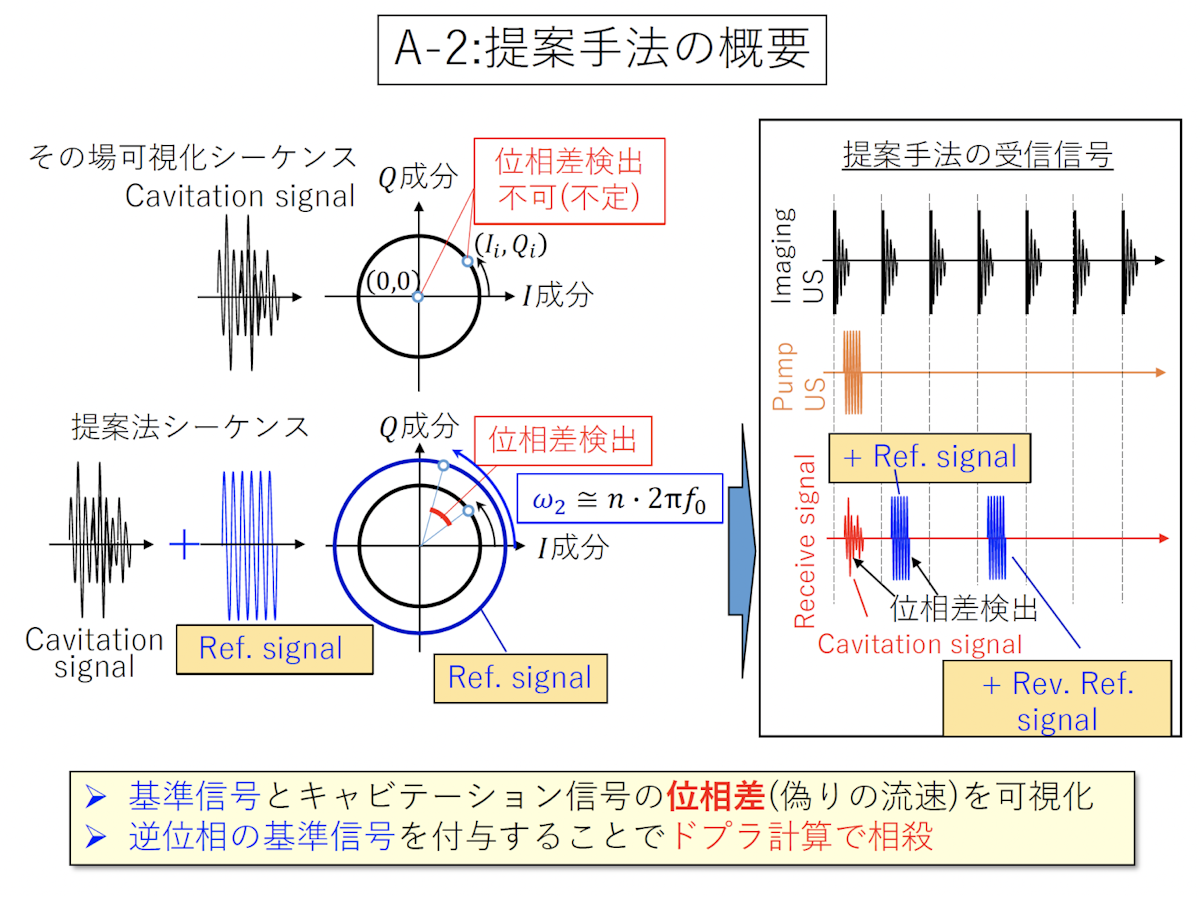
本来このモードは、ドップラーシフトを見ることで、血流の速さや向きを表示するために使用されます。これをそのまま気泡観測に適用しようとしても正確な移送情報が出現しません。この課題を解決するために、リファレンスとなる信号(基準信号)をこちらで与え、そのリファレンスとの位相差を検出することで気泡の周波数情報をその場で観測できるようにしました。
装置構成はパワードプラ画像を利用したその場観測法と似ていますが、超音波装置のプローブ前面に取り付けたフィルムセンサーは、受信の同期タイミングを取るためだけではなく、基準信号を与える役割も果たします。
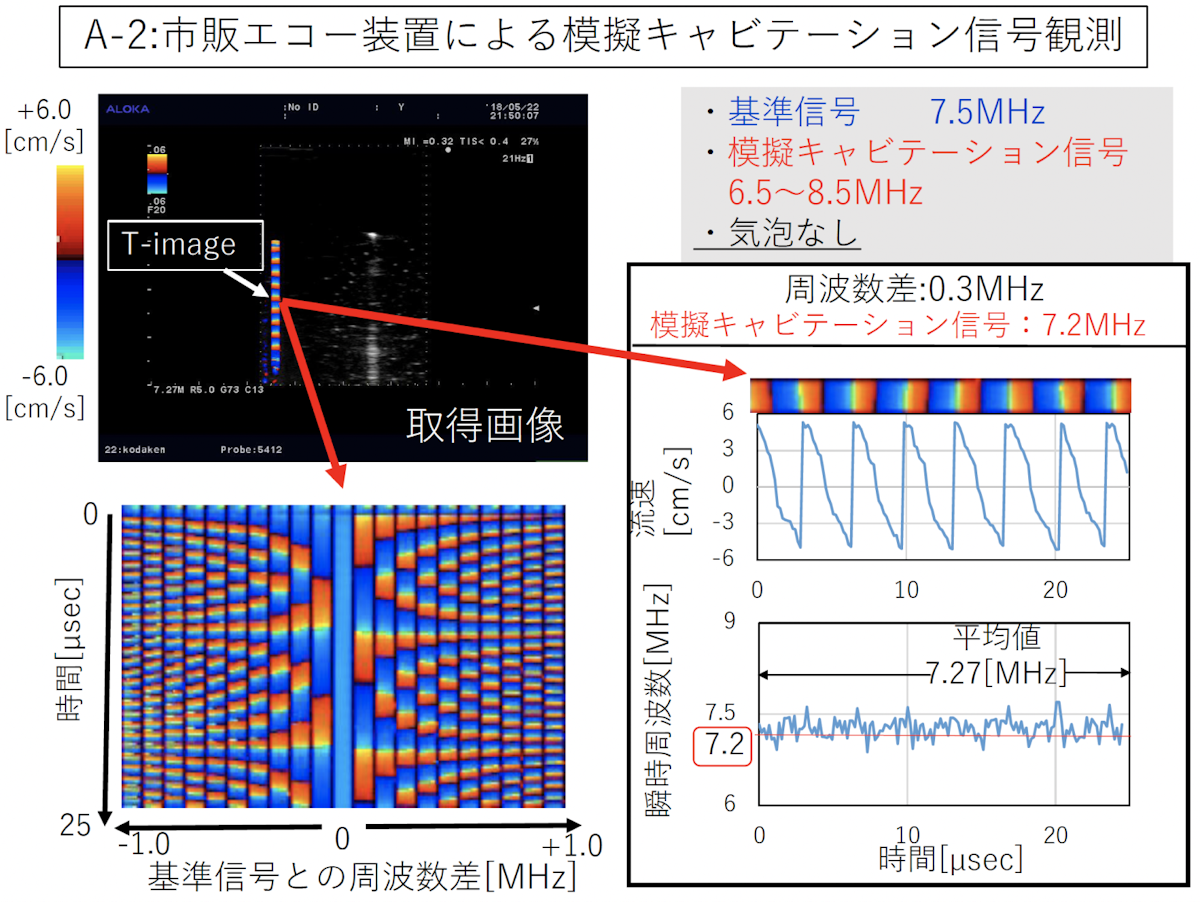
実験では、まず模擬キャビテーション信号(どういった信号が出るかわかってる制限波)をフィルムセンサーから入力し、入力した信号の周波数が可視化できるかということを確認しました。結果、基準信号と周波数差が可視化できました。
この方法を実際に気泡に適用し、弱い音圧と強い音圧の2種類の強力超音波を照射した際の観測結果が下図になります。弱い音圧のときは照射によって現れる周波数が一定なので、周波数と対応するような一定のパターンが現れています(下図左側)。一方で、高い音圧で照射を行うと気泡破壊が起こるので、その際に現れる周波数はインパルス的な周波数になり、可視化しようとしても綺麗なパターンにならず一見ランダムに見えます。ただし、照射が進んでいくと、今度は気泡がクラウド化を起こして割れ残った気泡からの信号になるため気泡破壊が起きず、綺麗な周波数を規定できるような一定のパターンになるということが観測できました(下図右側)。

気泡破壊を伴うキャビテーションのことをイナーシャルキャビテーションといい、気泡破壊を伴わない振動だけするキャビテーションのことステーブルキャビテーションといいますが、この方法で、イナーシャルかステーブルかといった区別がわかることになります。
研究開発装置を用いた観測
時間分解能・空間分解能を両立した観測法
研究開発用の超音波装置を用いた観測の一つ目は、時間分離能・空間分離脳を両立した方法です。この方法では、波動逆伝播を利用して気泡からの信号を可視化します。
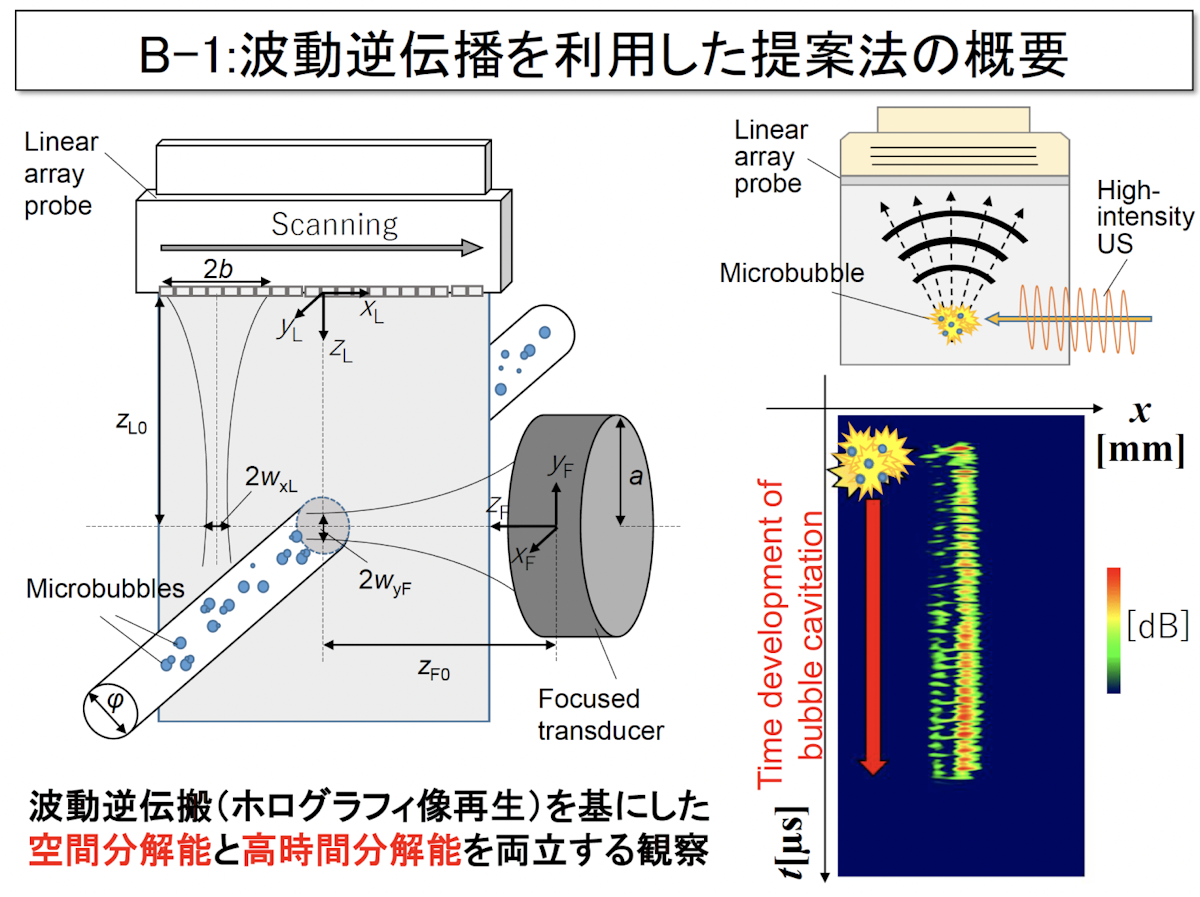
プローブでキャビテーション信号を受信した際、時間逆戻しを行って、元の気泡からの信号が発生した位置に戻すと、横軸が空間の次元を持っていて、縦軸が時間の次元を持つことになり、キャビテーションの時間発展が記録されることになります。これによって、空間分解能と時間分解能を両立した観察が可能となります。このときに映像化する項目は、一つは振幅に相当するパワーの画像、もう一つは瞬時周波数の画像になります。
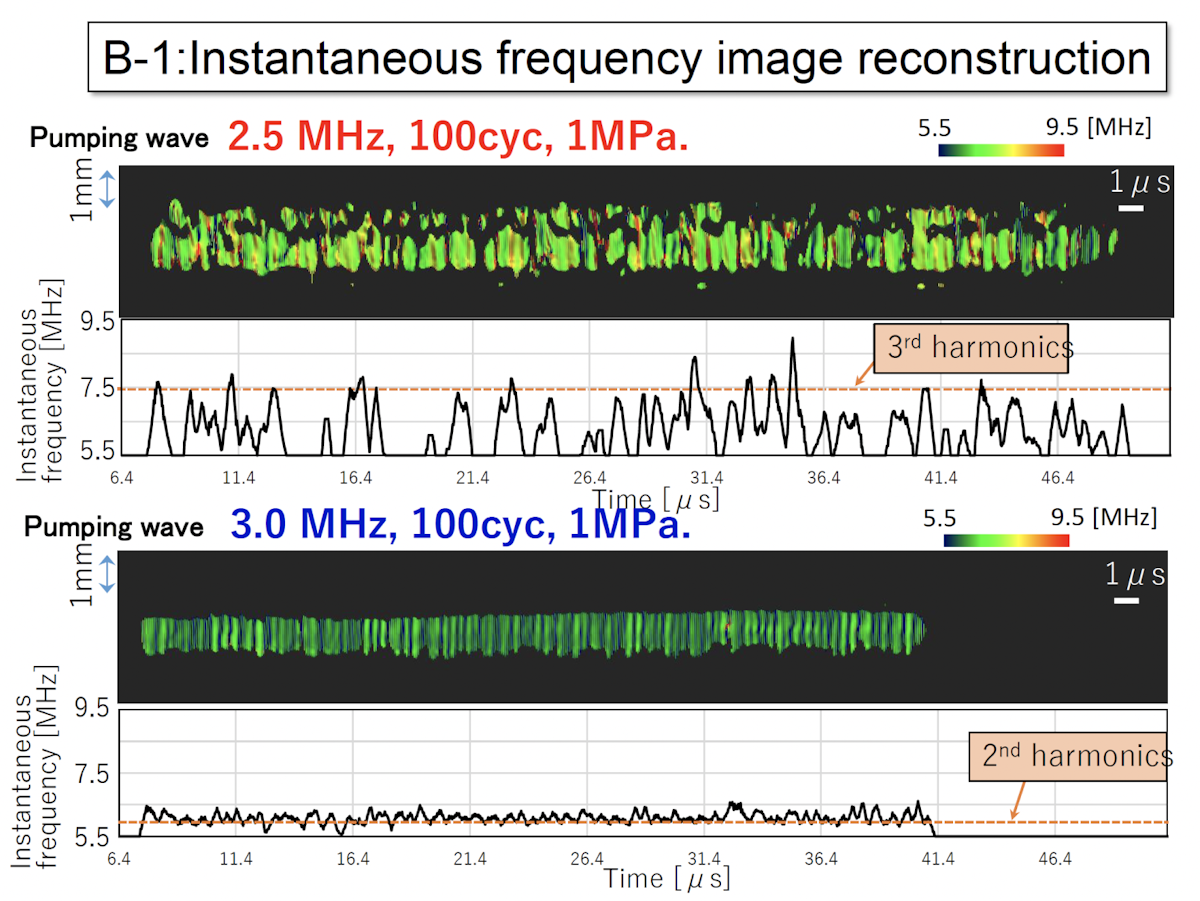
下図は瞬時周波数の画像結果です。上が2.5MHzを中心周波数とした強力超音波で、下は3MHzを中心周波数とした強力超音波で照射したものになります。こちらの画像は横軸が時間になっていて縦軸が空間の次元を持っています。 2.5MHzの照射時には様々な周波数が含まれていることがわかります。これは先ほどのカラードプラと同じように、気泡破壊により周波数が広帯域になり、様々な周波数成分が含まれているということを示しています。一方で、中心周波数を3MHzとした場合には、ほぼ発生する周波数が一定値になりました。これにより、照射した超音波の2倍高調波に相当する周波数で受信が行われていて、気泡破壊が発生していないことがわかりました。
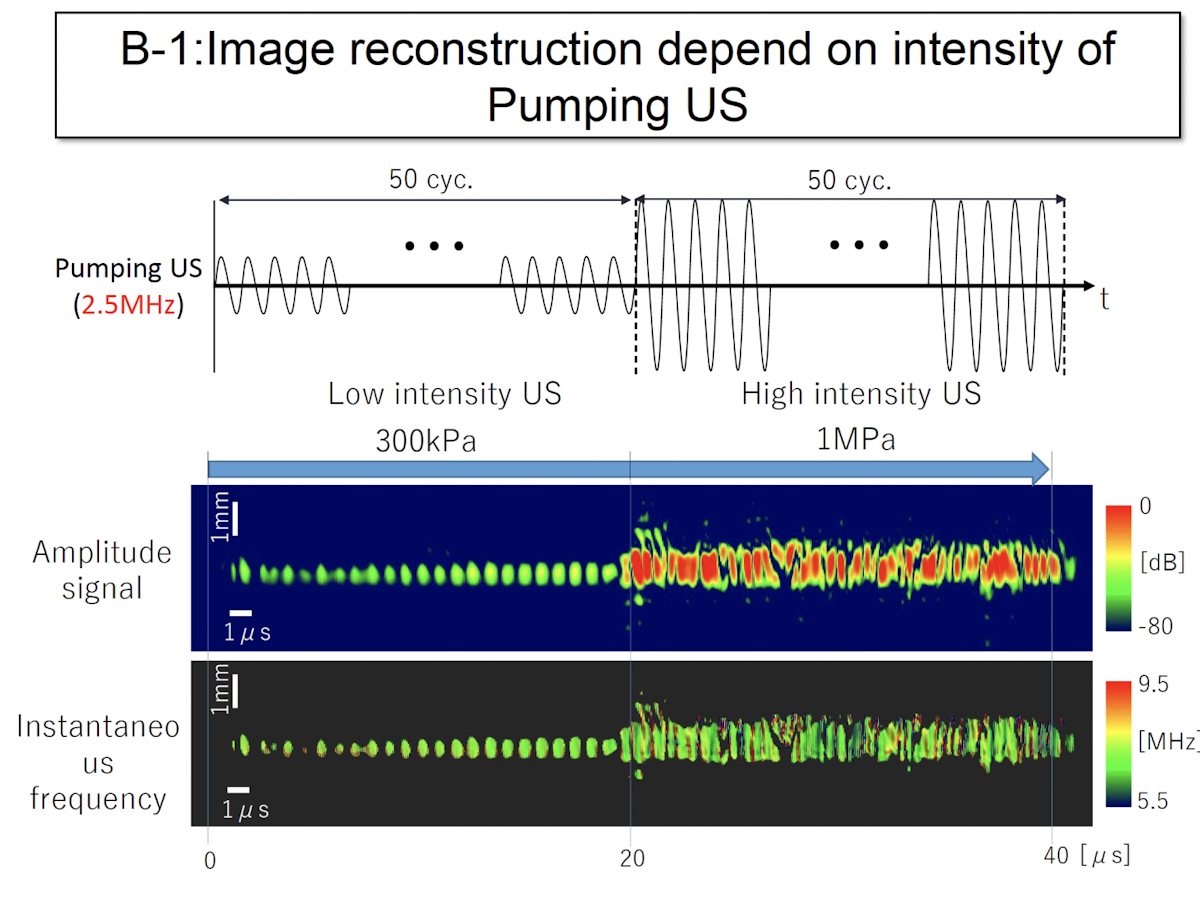
音圧を途中で変調して照射した画像結果がこちらになります。途中までは低い音圧で照射しているため周期的なパターンになっています。これは、2.5倍調波と3倍調波の2種類の周波数成分が発生し、それらによってビートが起こるからです。音圧を上げた場合には、気泡破壊を含むイナーシャルなキャビテーションになるため、現れるパターンはランダムに近いものになります。
浮遊細胞を用いた細胞実験
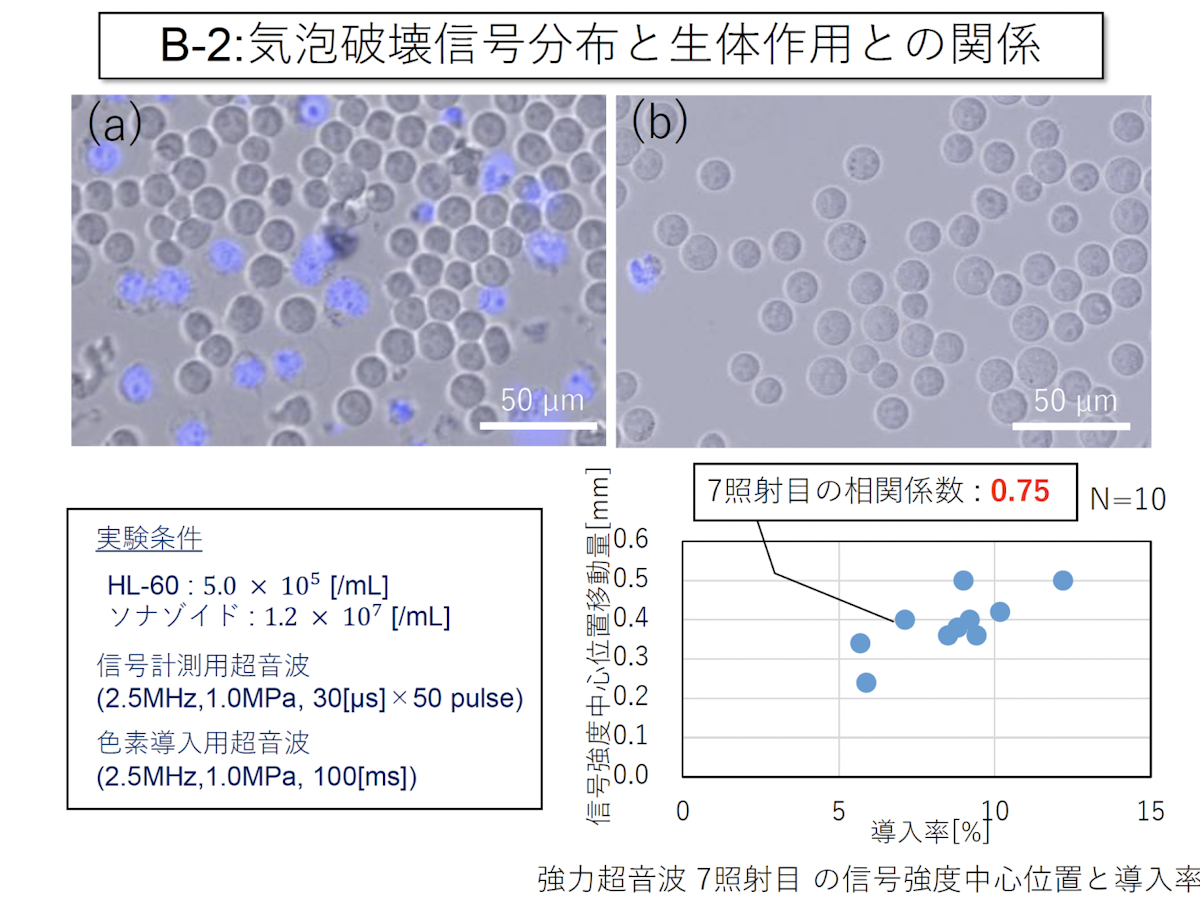
研究開発装置を用いた観測の二つ目は、浮遊細胞を用いた細胞実験です。浮遊細胞と一緒に気泡と蛍光色素を入れ、ここに超音波を照射することで細胞に蛍光色素を導入し、結果を検証しました。
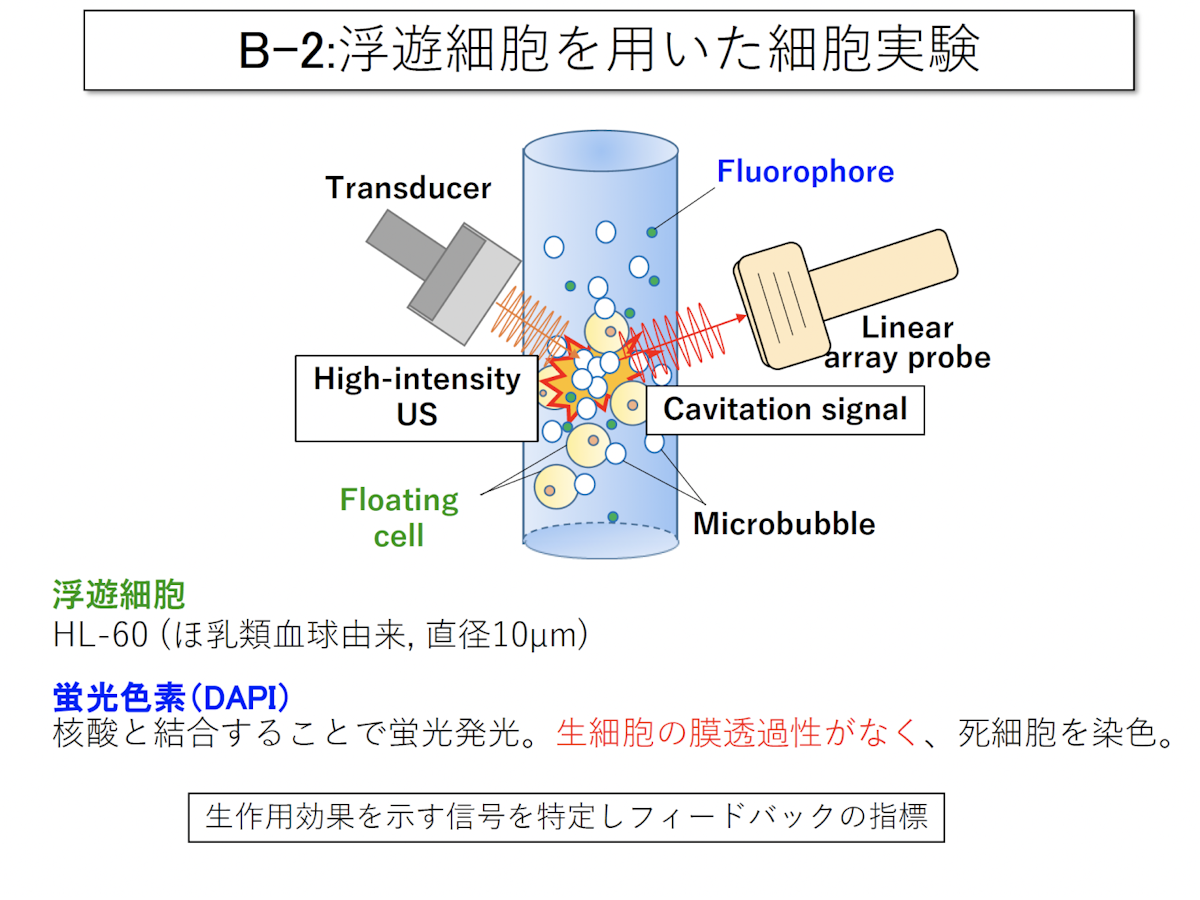
下図左側の青いものが、蛍光色素が導入されている細胞です。この青い細胞の数をカウントして導入率を提示し、今度は空間分解能を用いて信号強度中心位置の移動量を解析しました。その結果、移動量が大きいほど導入率が高いということがわかりました。
今後の取り組み
今後は、極微少量の気泡を検出する技術の開発に取り組み、早期診断の実現に寄与したいと考えています。具体的には、マクロファージなどの貪食細胞に取り込まれた非修飾気泡からの信号や、気泡をペプチド修飾して抗原抗体反応によって特定の細胞に修飾・結合させた表面修飾型気泡からの信号の検出を行う予定です。
また、時間分解能を上げていくということも必要になると思います。現在の測定レベルは、空間分解能数ミリ程度で時間分解能サブマイクロ秒程度ですが、気泡破壊を全て観測しようとすると、ナノ秒オーダーの時間分解能が必要になります。もちろん、ナノバブルへの応用を実現するために、現在ミリメートルオーダーである空間分解能も上げていく必要があると考えています。
団体情報

出展団体名 | |
|---|---|
所在地 | 〒371-8510 群馬県 前橋市荒牧町 4-2 群馬大学 荒牧キャンパス |
設立年月 | 2016年04月 |
従業員規模 | 501名以上 |
URL |






.png&w=1920&q=75)
